アプリケーションノート
Vol.3 | 酵母全遺伝子型DNAチップを用いた遺伝子発現解析
株式会社DNAチップ研究所
東レ株式会社
柱状構造からなる、酵母全遺伝子型チップ3D-Gene® Yeast Oligo chip 6kを用いた遺伝子発現解析の例を記す。本チップにはSaccharomyces Genome Database(SGD)に登録された5,888遺伝子に対するプローブが搭載され、出芽酵母Saccharomyces cerevisiaeの遺伝子発現を網羅的に解析できる。
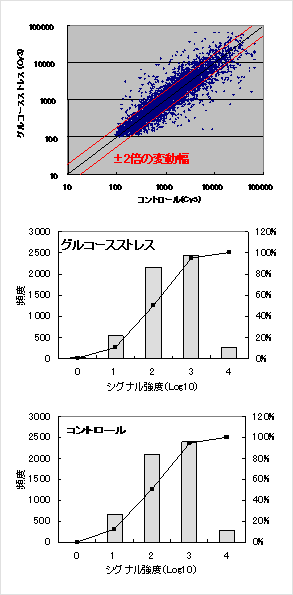 図1 酵母遺伝子の発現ヒストグラム
図1 酵母遺伝子の発現ヒストグラムまず、酵母株を5mlのYPAD培地で一晩、30℃で振とう培養(前培養)した後、OD660=0.1になるように150mlのYPAD培地に植菌、30℃で振とう培養した(本培養)。OD660が0.6にまで増殖したところで、本培養液を10mlづつ分配して集菌、滅菌水で洗浄した後、各々集菌した細胞に10mlのグルコースを含まない培地で細胞を再懸濁し、30℃で15~30分間穏やかに振とうした。コントロールとして、YPAD培地で細胞を再懸濁し、同様に振とうした。この再懸濁から集菌し得られた細胞を発現解析用酵母細胞とし、Schmittらの方法1)にしたがいtotal RNAを調整、競合ハイブリダイゼーションによる発現解析を行った。
図1の発現ヒストグラムに示すが、本DNAチップは低シグナルから高シグナルまで4桁近くのダイナミックレンジがあり、特に従来のガラス製DNAチップではノイズにより検出困難な低シグナル値の低発現遺伝子の解析も可能となる性能を持っている。
今回、対数増殖期においてグルコースストレスにより発現が特異的に誘導、もしくは抑制される遺伝子の絞り込みを試みた。好気的条件下では、グルコースは解糖系、TCAサイクル(クエン酸回路)、電子伝達系等の代謝系によって二酸化炭素および水にまで分解され、ATPを発生する。当然、これらの代謝系に関与する酵素をコードする遺伝子の多くは高発現となる。一方、グルコースが枯渇すると、グルコースのリン酸化がglucokinase(GLK1)やhexokinase(HXK1)によって強く誘導される、ペントースリン酸経路に関与する遺伝子群、グルタミン酸脱水素酵素(GDH1, GDH3)等の発現が強く誘導されること等が知られている。図2に糖代謝に関連する酵素の発現変化を網羅的に解析した結果を示すが、グルコースストレスによりHXK2の発現が抑制される一方で、HXK1やGLK1が特異的に強く誘導され、既存の情報2, 3)と一致した。またHXK以外に、PGMやADH等、相同性の高いタンパク質が複数存在するファミリー酵素についても特異的に機能する遺伝子が特定でき、本チップに搭載しているプローブの高い特異性(選択性)が確認された。
酵母は最も古くから研究されている生物の一つである。各遺伝子の機能に関する知識が豊富で、またそれらを記述したデーターベースの他、個々の因子を欠失した酵母ライブラリー4)が整備されている。今後、高い特異性をもつプローブと100倍の高感度を実現した新しいDNAチップ技術の組み合わせで、欠失ライブラリーを活用して極低発現な遺伝子の機能を網羅的に解明、データベースを充実化させる等により、真核細胞の「モデル生物」として世界中でより広範な分野で研究が行われると期待される。
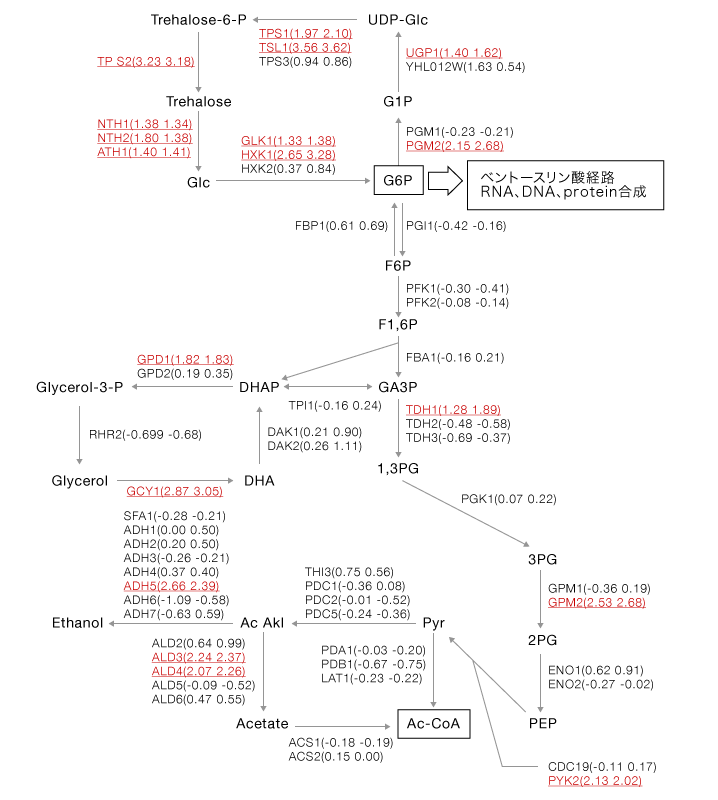
図2 糖代謝経路に関与する酵素遺伝子
[()内はDyeswap実験における変動比(log2)、赤字は2倍以上の発現亢進を示す]
参考論文:
- 1) Schmitt, et al. (1990) Nucleic Acids Res, 18:3091-3092.
- 2) Rodriguez A, et al. (2001) Biochem J 355:625-31.
- 3) Lobo Z and Maitra PK (1977) Arch Biochem Biophys 182(2): 639-45
- 4) http://www-sequence.stanford.edu/group/yeast_deletion_project/deletions3.html
ProbeBank®のご紹介
マイクロアレイは1度に多くの遺伝子発現状態を検出できる画期的な技術です。しかし、これまでのマイクロアレイは、発現量の少ない遺伝子を検出することが困難であるとされています。また、クロスハイブリダイゼーションによる擬陽性なシグナルが検出されるという問題点もあります。ProbeBank®はこれらの問題点を解決するために、独自のプローブ設計技術と高品質DNA合成技術を駆使し、遺伝子発現の微弱な変動を検出し、かつ既存のオリゴセットよりも特異性・再現性に優れたオリゴヌクレオチドセット作成をコンセプトとして開発されました。
1. 高品質DNAによる高い再現性
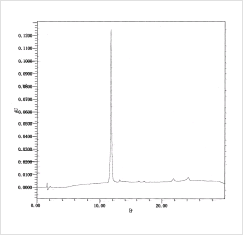 図3 ProbeBank® オリゴの簡易精製後逆相HPLC分析
図3 ProbeBank® オリゴの簡易精製後逆相HPLC分析DNAチップの基板表面上には、遺伝子特異的なオリゴヌクレオチドを固定化します。この固定化には、“糊”の役割を果たす「アミノ基」をオリゴヌクレオチドの末端に導入しなければなりません。このアミノ化されたオリゴプローブはそれぞれ化学合成されますが、これまでの合成では精製段階にかなりの時間を要し、そのためDNAチップの作製において不純物の除去が十分ではありませんでした。また、基板表面との反応効率が乏しく、多量のプローブが必要でした。
これらの問題点を解決するために、DNAチップ研究所と産総研では新規アミノ化試薬の開発を行い、これに成功しました。この新規アミノ化試薬の導入によって、(1)プローブを高純度かつ迅速に供給することが可能となり(図3)、(2)溶液中ならびに基板表面におけるオリゴプローブの反応効率の向上を達成しました。ProbeBank®はこの新規アミノ化オリゴヌクレオチドをプローブとして用いることにより、チップごとのバラつきの少ない高品質のDNAチップ製造に最適のオリゴプローブです。
2.プローブの設計方法
東京大学大学院新領域創成科学研究科の森下教授と山田助手らが開発した、特異性データベース*1 を活用し、遺伝子特異的な領域を選択することで特異性を高めクロスハイブリの可能性をより低く抑えています。さらに森下教授とDNAチップ研究所が共同で開発した設計アルゴリズムにより、ターゲットの濃度依存的に蛍光強度が上昇する配列を選択しました。これにより、どのようなサンプルでも再現性の高い、高品質な解析結果を得ることができます。
3.プローブの評価技術
DNAチップ開発、受託解析メーカーとしてビジネスを展開してきたDNAチップ研究所が、これまで培ってきた経験と技術を基に構築した独自のプローブ評価手法により全てのプローブを評価しています。規定の条件を満たさないプローブについては再度、設計をやり直し再評価を行っています。これによりコンセプト通りの機能を果たすことのできる優良プローブを選別しています。
*1
Tomoyuki Yamada and Shinichi Morishita. Computing Highly Specific and Noise Tolerant Oligomers Efficientlyly, Journal of Bioinformatics and Computational Biology, Vol. 2, No. 1, pp21-46, 2004.KTomoyuki Yamada, Haruhiko Souma, Shinichi Morishita.PrimerStation: a highly specific multiplex genomic PCR primer design server for the human genome. Nucleic Acids Res. 2006 Jul 1;34(Web Server issue):W665-9.
Web Site: http://ps.cb.k.u-tokyo.ac.jp/

